基礎的物理学・科学
温度
温度計の目盛りは2種類あり、摂氏温度(℃)と絶対温度(K)がある。

絶対温度は、-273.15K が下限なので、ここより下には下がらない
熱量
熱とはエネルギーである。そして、熱が熱い鉄から 冷たい鉄へ伝わるときの 熱の量を熱量といい、単位はジュール(J)を使う。これは国際単位である
比熱とは、物質1g単位の温度を1K(1℃)上げるのに、必要な熱量のことを指す
- 同じ質量の物質でも、温まりやすいものと温まりにくいものがある。この温まりにくさを表すものが比熱である
- 比熱が大きな物質は、温まりにくく、冷めにくい
- 水の比熱が物質の中で最も大きい(約4.2 J/g・K)
熱容量:
熱容量とは、物質全体の温度を、1K(1℃)高めるために必要な熱量のことをいう
- 「熱容量=物質の比熱×物質の質量」
- 物質が温度上昇するときに必要な熱量の計算方法
熱量(ジュール)=比熱(J/g・K)×質量(g)×上昇した温度(℃)
熱の移動:
熱の移動方法は3つある
1.伝導
- 温められた物質の中で、高温部から低温部へ熱が移る伝わり方のことを伝導という
- 物質には伝導による熱の伝わりやすいものと伝わりにくいものがあり、この熱の伝わる割合のことを熱伝導率という
- 熱伝導率は、固体(特に金属)>液体>気体の順番に高い
- 金属は熱伝導率が高いので燃えない
- 紙は熱伝導率が小さいからすぐ燃える
2.対流
容器の水を下から熱すると、温度の高くなった水は膨張して軽くなるため上昇し、温度の低い水は重いため下降する。このような温度差によって生ずる流動を対流という

3.放射
高温の物体が発生する放射熱が、光や赤外線の形で空間を伝わってくるような熱の伝わり方を放射(輻射)という
熱による変化
物質に熱が出入りすると温度変化をする以外にも、さまざまな変化が起きる
熱膨張
熱膨張とは、物質を熱して温度が上がると長さや体積が増え、逆に冷やすと長さや体積が減ずることを指す

熱膨張はさらに2つに分けられる
1.線膨張…物質の長さが増える (例:線路)
2.体膨張…物質の体積が増加する (例:ガソリン)
・体膨張率の順番は、気体>液体>個体の順に気体がもっとも大きく、個体がもっとも小さい
・体膨張後の全体積を求める公式は、
V=Vo(1+B×T)
V=膨張後の全体積、Vo=液体の元の体積、B=体膨張率、T=温度差
物質の変化
一般的に、物質には、固体、液体、気体の三つの状態(物質の三態)があり、同じ物質であっても、その状態は、温度や圧力によって変化する
水は液体ですが、温度が下がれば固体(氷)温度が上がれば気体(水蒸気)になる
状態変化(物理変化)
物理変化…形状や大きさ、状態が変化するが、原子や分子のレベルから見た本質は変化しない
(例)水が氷や蒸気になる。放置したドライアイスがなくなる
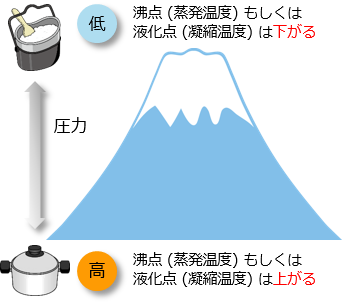
気化(蒸発)によってできた蒸気の圧力を、飽和蒸気圧という
液体の飽和蒸気圧と外圧が等しくなる時の液体の温度を沸点という

液体は、その表面にかかる圧力が大きくなると沸点は高くなる
化学変化
化学変化…原子や分子のレベルで付いたり離れたりして、性質の異なる別な物質に変化すること
(例)酸化や化合。空気中に放置した黄りんが自然発火。木炭を加熱すると表面が赤くなる
その他の変化
潮解
空気中の水分を吸ってベトつき、ドロドロに溶ける現象
(例)盛り塩が溶ける
風解
結晶水(結晶を作るために必要な水分)をもつ物質(結晶)を空気中に放置しておくと、結晶水が蒸発し、ボロボロとくずれる現象
(例)古いお墓がボロボロになっている
溶解
物質が液体に溶けることを溶解という(物質が固体から液体に状態変化する融解とは違う)
一般的に液体は溶液という
溶けている物質を溶質という
溶かしている液体を溶媒といい、溶媒が水の場合は特に水溶液とよんでいる
物質の三態
身の周りにある物質は気体・液体・固体の3つの状態に分けることができ、物質の三態とよぶ
気体
一定の表面を示しにくく、一定の形を持たない
- 圧縮されやすく、容器内で温度が一定なら、その機体にかかる圧力が大きくなる程、体積は小さくなる(ボイルの法則)
- その種類に関係なく気体の圧力が一定ならば、温度が1℃上がるごとに0℃の時の体積と比べ、約273分の1ずつ体積が増す
- もっとも密度の小さい(軽い)機体は水素(H₂)である
液体
一定の表面を示すが、決まった形をもたない(流動性がある)
固体
結晶性を持つものを固体というが、「決まった形と体積を持った固いもの」と考えてよい
密度と比重
- 密度とは、物質の単位面積1cm³あたりの質量(g)をいう
- 密度(g/cm³)=質量(g)÷体積(cm³)
- 水は4℃のときが密度が最大となり、1(g/cm³)である
- 比重(比重に単位は無い)とは、ある物質が同体積の水の「何倍の質量があるか」を表す値であり、4℃の水の密度を比重1として、比較した値である。ほとんど水より軽いので浮く
- 比重が3の物質は、水の質量の3倍であるといえる
- 「比重=物質の密度(g/cm³)÷4℃の水の密度(g/cm³)」
物質の成り立ち
すべての物質の最小単位は原子といい、それ以上細かく分けることができない。物質はこの原子が単独で並んでいたり、色々な割合で結び付いて構成されている
この原子の種類を元素といい、元素名はすべて元素記号で表される
特有の性質を備えた最小粒子の物質を分子という。1個または数個の原子が結合して出来たものであり、その分子を構成する「原子の種類」や「原子の数」を表すものが分子式である
(例1)水は「H₂O」と分子式で表され、水素原子2個と、酸素原子1個から出来ている
(例2)炭酸ガスは「CO₂」と分子式で表され、炭素原子1個と酸素原子2個から出来ている
物質の分類
純物質
・1種類の純粋で単一な物質。融点、沸点が常に一定。化学式がある。純物質には単体と化合物がある
混合物
・2種類以上の純物質の、単体や化合物が化学変化することなく混ざり合ったもの
・組み合わせによっては融点、沸点が変化して一定でない物質。化学式が無い
・混合物は化学式で表すことが出来ない
同素体
同素体とは、同じ原子で出来ている単体でありながら
科学的性質が異なるもの同士のことをいう
同素体は、4つ覚えておけばよい
S硫黄、C炭素、O酸素、Pリン
→覚え方は、 SCOP(スコップ)と覚える
上記の詳細:
・斜方硫黄S8、単斜硫黄S8
・ダイヤモンドC と 黒鉛(グラファイト)C
・酸素O2 と オゾンO3
・黄リンP4 と 赤リンPn
異性体
同じ種類の原子を持っているが、違う構造をしている物質のこと。
例: エタノールとジメチルエーテル、ブタンとイソブタン、キシレンのオルト、メタ、パラ)
同位体
原子番号が同じで、質量数の異なる原子同士のこと
物質の変化
・物質の変化は、本質的な変化である化学変化と、物質の本質は変わらず外見だけが変化する物理変化に分けられる
物質が酸素と結合することを酸化、
物質が酸素を失うことを還元と言う
他に、
電子e⁻(水素)を失うことも酸化と言い、
電子e⁻(水素)と結合することも還元と言う
化学変化において、酸化と還元は必ず同時に起こる
相手を酸化させる物質を酸化剤といい、相手を還元する物質を還元剤という
金属の性質
・水銀は液体の金属である
・比重が水より軽い金属がある(カリウム、ナトリウム)
化学変化のいろいろ
化合
2種類以上の物質が結び付いて化学変化を起こし、全く異なった新しい物質(化合物)ができる変化を化合という
分解
1種類の物質から2種類以上の新しい物質ができる化学変化をいう
化学変化において、熱を発生する反応を発熱反応。熱を吸収する反応を吸熱反応といい、化学反応によって出入りする熱を反応熱という
化学反応式
矢印の左右で原子の数が等しくなるように、化学式の前に係数をつける。(係数1は省略する)
2H₂ + O₂ → 2H₂O
化学の基本法則
① 質量保存の法則
化学変化の前後では、物質全体の質量の総和は変化しません
② 倍数比例の法則
異なる2種の元素からなる化合物では、一方の元素の一定質量と化合する他の元素の質量は、簡単な整数比になります
炭素24gと酸素が反応し二酸化炭素になる場合、64gの酸素が反応し、88gの二酸化炭素が生成します。
この場合、炭素と酸素の質量比は、24:64=3:8になります
③ 定比例の法則
同じ化合物であれば、化合物を構成する元素の質量比は常に一定です

④ アボガドロの法則
すべての気体1molは、標準状態で22.4リットル、気体分子数は6.02×1023個です
元素の周期表
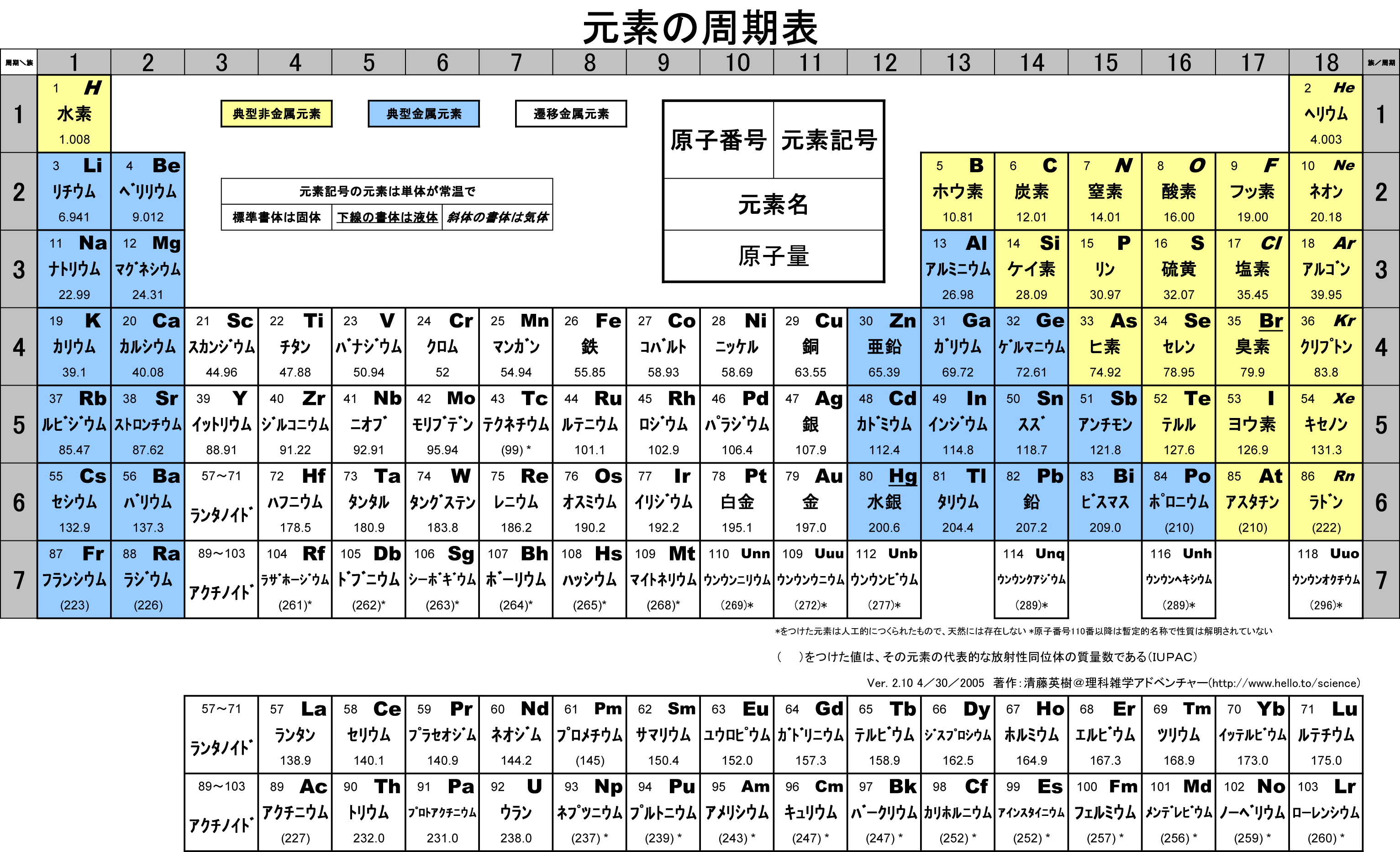
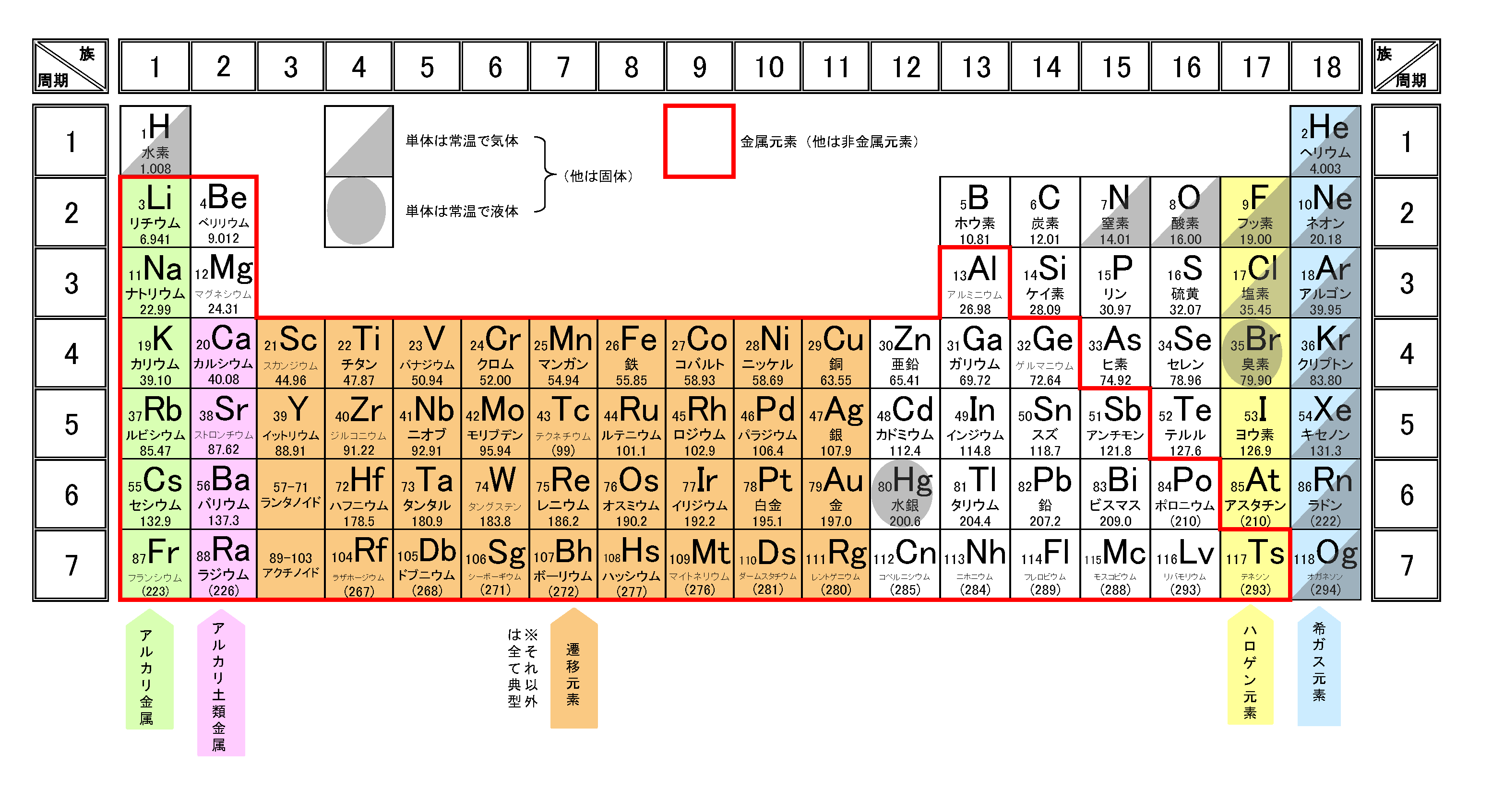
金属の性質
イオン化傾向
単体の金属が水溶液中で電子を失って陽イオンになる性質をイオン化傾向といい、
イオン化傾向が大きいほど酸化されやすく強い還元力となります。
酸化とは物質が酸素と結びつくこと。化合物が水素原子を失うこと。物質が電子を失うこと。
還元とは物質が水素と結びつくこと。化合物が酸素原子を失うこと。物質が電子を得ること。

金属の腐食
内部の鉄板が錆びやすいか、錆びにくいかは、
鉄が酸化されやすいか、酸化されにくいか ということである
金属には「イオン化傾向」という 陽イオンになりやすい順番があって、
この「イオン化傾向」が大きいと 酸化されやすくなる
一方、電気化学的腐食から防ぐ方法の一つとして、鉄よりイオン化傾向の大きい異種金属と接続することにより防食作用がある
① 温度・湿度の変化が大きい
② 酸性の強い環境である
③ 強アルカリではないコンクリートの中
④ 塩分が多い
⑤ 異なった金属との接触
⑥ 迷走電流の流れる土壌中
電解質と非電解質
純粋はほとんど電流を通さないが、水などに溶かすとイオンとなり溶液が電気を伝えるようになるものと、伝えないものがある
そこで、電流を通すものを電解質といい、電流を通さないものを非電解質という
電解質の例: 食塩、塩酸
非電解質の例: 砂糖、エタノール
酸と酸性
水溶液の中で、水に溶けて+イオンと-イオンに分かれる事を電離という
・電離して水素イオンH⁺を放って、酸性を示す物質を酸という。
・酸の溶液はすっぱい味がある。金属と反応すると水素が発生する
・青色リトマス紙を赤色にする
酸性は、青色リトマス紙を赤色に変える
青赤があがるのは親も賛成
塩基とアルカリ性
・電離して水酸化物イオンOH⁻を放出し、アルカリ性を示す物質を、塩基またはアルカリという
・塩基の水溶液には苦い味がある。皮膚に付けるとぬるぬるする
・赤色リトマス紙を青色にする
中和と塩
・酸の水溶液と塩基の水溶液を混合すると、水素イオンと水酸化物イオンが結び付いて、それぞれの性質が失われる反応が起きる。このことを中和といい、塩と水ができる
・塩には水に溶けるものと溶けないものがある
pH
pH(ペーハー)は、水素イオン指数ともいう
水溶液の程度が、酸性なのか塩基性(アルカリ性)なのかを示す単位がpHである
- pHの値は、左側の0に近いほど「酸性が強い」=「金属が腐食しやすい」
- pHの値は、7が中性である
- pHの値は、右側の14に近いほど「塩基性が強い」=「金属が腐食しにくい」
燃焼の基礎知識
燃焼は酸化の一種である
・燃焼の定義は、物質が熱と光を出して、酸素と激しく化合する(酸化反応)ことである。熱と光が出ない酸化は、燃焼とは言わない
・可燃物は燃焼すると、より安定な酸化物に変わる
・燃焼に必要な燃焼の三要素
①可燃物
②酸素供給源(支燃物)
③点火源
例: ローソクのロウ、(空気の中の)酸素、マッチの火
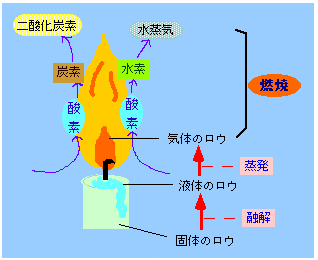
・酸素と化合する物質であれば、固体/液体/気体でもほとんどが可燃物になる。逆に、酸素と化合しないものは不燃物になる
・特に有機化合物の多くは可燃物である
(有機化合物:炭素を主体とした化合物のこと。反意語は無機化合物)
・有機化合物は一般に融点が低いものが多く、熱に弱いので燃えやすい
(木、石炭、ガソリンが燃えやすいのも、成分に有機化合物を含んでいるため)
・空気に約21%含まれる酸素が酸素供給源である(厳密には、空気は酸素供給源では無い)
・空気が無くても、摩擦等によって分解して発生する酸素が、酸素供給源となる
・第五類危険物が、分子内に含む酸素が酸素供給源で自己燃焼(自分で酸素を供給しながら自分で燃える)する
・点火源は「可燃物と酸素を活性化させるエネルギーを与えるもの」であり、身近な例では、炎、静電気などの火花、摩擦熱などがある
・摩擦すると一方に正の電気、他方に負の電気を帯びて、静電気が発生して放電火花を発生し、点火源となりえる
・静電気を帯びているものを接地すると、アースとなって蓄積している静電気を地面に逃がすことができる。電気は抵抗が少ないものにより多く流れようとするので、人体よりも抵抗が低く、電気が流れやすいアースがあると、そちらに多くの電流が流れるので助かりやすくなる
・湿度を高める(75%以上)と、物体表面の水分を通して静電気が逃げるので、静電気が蓄積しずらくなる
・送油作業では、油の流速が大きいと、流体摩擦で静電気が発生する
燃焼の仕方
気体
気体の燃焼は2種類ある
・拡散燃焼
・予混合燃焼
液体
蒸発燃焼:
蒸発燃焼とは、液体は液体のまま燃えるのでは無くて、液体の表面から蒸発した蒸気(混合ガス)が酸素と混合して燃焼することをいう
例: ガソリン、灯油、アルコールなどの燃焼
固体
固体の燃焼は4種類ある
分解燃焼:
分解燃焼とは、可燃物が熱によって分解しそのときに生じる可燃性ガスが燃焼する
例:木材、石炭の燃焼
自己燃焼(内部燃焼):
自己燃焼とは、可燃物自体が酸素を含んでいるので、自己反応によって燃焼する
例:第五危険物のセルロイドの燃焼
表面燃焼:
表面燃焼とは、可燃性の固体が蒸発も分解もせずに、固体の表面で燃焼する
例:木炭、コークスの燃焼
蒸発燃焼:
蒸発燃焼とは固体が熱によって融解し、さらに蒸発して気体に変わり燃焼する
例:硫黄の燃焼
燃焼の難易度
物質の燃焼の難易度(燃えやすさ・燃えにくさ)は、いろいろな条件に左右される。物質が燃えやすいときの条件は以下となる
① 酸化されやすい:
燃焼は酸化反応の一種なので、酸化されやすいものほど燃えやすい
② 酸素との接触面積が大きい:
丸太は細かく切った方が酸素により多く触れて燃えやすくなる。金属も粉末にしたほうが燃えやすくなる
③ 熱伝導率が小さい:
熱伝導率が小さい(熱を伝えにくい)ものは、加えられた熱が1か所に溜まるので燃える
④ 発熱量が大きい:
燃焼による発熱は、さらに燃焼をうながす役割をする
⑤ 乾燥している:
水分が少ないものほど燃えやすい
⑥ 可燃性ガスを発生しやすい:
加熱されて可燃性ガスを多く発生する物質は燃えやすくなる
⑦ 周囲の温度が高い:
周囲の温度や、可燃物の温度が高いほど燃えやすくなる
引火点とは
液体の可燃物が燃焼するには、燃焼に必要なだけの蒸気が発生していないといけない。液体の温度が高いと、その分、蒸気の量も増える。蒸気が燃焼に必要な濃度に達したときの液体の最低温度を引火点という
物質によって引火点は異なるが、引火点の低いものは、すぐに蒸気が燃焼に必要な濃度に達しやすいので、引火の危険性が高い
発火点とは
可燃物を空気中で加熱したとき、点火源が無くても自ら発火(爆発)を起こすときの最低の温度を発火点という。発火点も引火点と同じく、物質によって異なり、低いものほど危険である
・ガソリンだと約300℃
自然発火とは
空気中で常温状態(20℃)の物質が、加熱をしていないのに自然に発熱し、長時間その熱が蓄積されて発火点に達して燃焼を引き起こす現象を自然発火という
発熱の原因の例:
・分解熱(セルロイド)
・酸化熱(石炭)
・微生物による発酵(堆肥)
・吸着熱(活性炭)
などがある
燃焼範囲とは
可燃性の液体は、液体表面から発生する蒸気が薄いと引火しないし、濃すぎても引火はしない。つまり、蒸気と空気の混合の割合が、一定の範囲の中でだけ 点火すると燃える
この時の空気中の蒸気濃度の範囲を燃焼範囲といい、たとえばガソリンの燃焼範囲が1.4~7.6%であり、これより濃すぎても薄すぎてもガソリンは引火しない

消火
燃焼の三要素(可燃物、酸素供給体、点火源)のうち、どれかを取り除くのが消火の基本となる
可燃物を取り除く →除去効果
例1: ガスの元栓を締めて火を消す(可燃物であるガスを遮断する)
例2: ローソクの炎を吹き消す(可燃性の蒸気を息で吹き飛ばす)
酸素供給体を取り除く →窒息効果
空気中に約21%含まれる酸素濃度が、約14%以下になると窒息効果により消火できる
例1: アルコールランプの炎に蓋をして消す(酸素の供給を絶つ)
例2: 不燃性の泡で燃焼物をおおう(泡消火剤など)
例3: 二酸化炭素で燃焼物をおおう(二酸化炭素消火剤など)
例4: 石油類の火炎で乾燥砂を散布して消す(第四類危険物の火災にも用いられる)
ただし、分子内に酸素を含有するセルロイドなどの第五危険物(自己燃焼するもの)や、有機過酸化物は、窒息効果では消化できない
例5: 炭酸ガス消火剤、粉末消火剤、蒸発性液体消火剤
点火源を取り除く →冷却効果
燃焼している物体の温度を発火点・引火点未満に抑え、可燃性蒸気の発生を抑えて消火する方法
例1: 注水や、スプリンクラーで消化する
例2: 強化液(水の消化能力を強化した液体)による消火
火災
火災は3種類あり以下となる
| 火災の種類 | ー | 地色 | 具体例 |
|---|---|---|---|
| 普通火災 | A火災 | 白 | 木材、紙などによる火災 |
| 油火災 | B火災 | 黄 | 引火性溶液による火災 |
| 電気火災 | C火災 | 青 | 電線、モーターなどによる火災 |
消火剤
消火器に使われている代表的な消火剤はいろいろあり、以下となる
水、強化液、泡、ハロゲン化物、二酸化炭素、粉末
水
水は比熱と蒸発熱が大きいため、燃焼物から大量の熱を奪い、その冷却効果で消化が行われる。さらに蒸発した水蒸気で、周囲の空気の酸素濃度を低くする窒息効果もある。
しかし、油火災に注水をすると油が水に浮いて逆に火災が広がるので、油火災には厳禁である。水消火器は、ノズルを切り替えることができ、棒状放射と霧状放射(噴霧)になる
水の棒状放射は普通火災に適していて、霧状放射(噴霧)は普通火災と油火災に適している
強化液
強化液は、水に炭酸カリウムなどのアルカリ金属塩類を加えて、消化能力や再燃防止作用を高めたものである。⁻20℃でも凍らないので寒冷地でも使用できる。他の特徴は水と同じだが、霧状に放射した場合は水のときと同様に、負触媒効果によって油火災でも消火できる
ある方向の反応速度を速めたり遅くしたりする物質を触媒といい、とくに反応速度を遅くするものを負触媒効果(抑制効果)という
泡
泡消火剤は、燃焼物を泡で覆い、窒息効果によって消火するもの。普通火災、油火災に適応するが、電気火災の場合は感電のおそれがあるので適していない
ハロゲン化物
ハロゲン化物消火剤は、ハロン系を主成分とした消火剤で、放射すると蒸発して不燃性ガスに変わり、燃焼物をおおって負触媒効果や窒息効果で消化する。しかし、ハロゲン化物のガスは地球成層圏のオゾン層を破壊するため現在では生産されていない
二酸化炭素
二酸化炭素消火剤は、炭酸ガスを圧縮して液体の状態で消火器に充填し、放射すると気化して燃焼物をおおい、窒息効果で消化する消火剤です。毒性は無いが、狭い場所では酸欠に繋がる。油火災や電気火災に適している
粉末
粉末消火剤は、リン酸アンモニウムや炭酸水素ナトリウム(重曹)の粉末を炭酸ガスなどの圧力で放射し、窒息効果と負触媒効果によって消火する
※リン酸アンモニウムを使ったものは、普通火災、油火災、電気火災のどれにも適合していて、ABC消火器とも呼ばれている。現在の家庭用小型消火器は、ほとんどがこのタイプである
各消火剤の一覧:
| 消火剤の種類 | 放射方式 | 主成分 | 消火方法 (~効果) | 適応する火災 | 備考 |
|---|---|---|---|---|---|
| 水 | 棒状放射 | ・水 | ・冷却 ・窒息 | A | |
| ー | 霧状放射 | ・水 | ・冷却 ・窒息 | A・C | |
| 強化液 | 棒状放射 | ・炭酸カリウムの水溶液 | ・冷却 ・窒息 | A | |
| ー | 霧状放射 | ・炭酸カリウムの水溶液 | ・冷却 ・窒息 | A・B・C | |
| 泡 | 普通泡 (化学泡、 機械泡) | ・炭酸水素ナトリウム ・硫酸アルミニウム ・界面活性剤など | ・窒息 ・冷却 | A・B | |
| ー | 特殊泡 | ・水溶性液体用泡 (特殊泡) | ・窒息 ・冷却 | A・B | |
| ハロゲン化物 | ー | ・ハロン1301 ・ハロン2402 | ・負触媒 ・窒息 | B・C | 現在は不使用 |
| 二酸化炭素 | ー | ・液化二酸化炭素 | ・窒息 | B・C | |
| 粉末 | ー | ・リン酸アンモニウム (リン酸塩類) | ・窒息 ・負触媒 | A・B・C | |
| ー | ー | ・炭酸水素ナトリウム | ・窒息 ・負触媒 | B・C |
ちなみに私が使用していたテキストはこちらです。


コメント